在蛋白質(zhì)研究與應(yīng)用中,“精準(zhǔn)標(biāo)記”與“定向功能化”是突破技術(shù)瓶頸的關(guān)鍵,不僅要保證蛋白質(zhì)天然活性不受影響,又要實現(xiàn)修飾分子的位點可控、高效偶聯(lián)。對于傳統(tǒng)化學(xué)偶聯(lián)的隨機修飾、產(chǎn)物不均一問題,長期制約著蛋白質(zhì)在科研與產(chǎn)業(yè)中的價值釋放。而分選酶A(SortaseA)介導(dǎo)的生物偶聯(lián)技術(shù),以其“位點精準(zhǔn)、反應(yīng)溫和、普適性強”的獨特優(yōu)勢,業(yè)已成為蛋白質(zhì)標(biāo)記與功能化領(lǐng)域的“明星技術(shù)”,為各類應(yīng)用場景提供了標(biāo)準(zhǔn)化解決方案。
一、蛋白質(zhì)修飾的“精準(zhǔn)導(dǎo)航系統(tǒng)”
分選酶A具有嚴(yán)格的“底物識別-催化偶聯(lián)”機制:
識別精準(zhǔn)性:僅特異性結(jié)合目標(biāo)蛋白上的LPXTG短肽標(biāo)簽,修飾分子需攜帶互補的甘氨酸序列,形成“鎖鑰式”配對。
反應(yīng)溫和性:無需高溫、強酸堿或有毒化學(xué)催化劑,在生理條件下(pH6.5-8.0、室溫)即可高效反應(yīng)。
偶聯(lián)穩(wěn)定性:催化形成的肽鍵在體內(nèi)外均具備高度穩(wěn)定性,不易水解或脫靶,解決了傳統(tǒng)化學(xué)偶聯(lián)(如馬來酰亞胺-巰基反應(yīng))中修飾分子易脫落的問題。
二、蛋白質(zhì)標(biāo)記與功能化的關(guān)鍵應(yīng)用場景
①熒光標(biāo)記與動態(tài)追蹤:Dillard KE等人研究提出了一種分選酶介導(dǎo)的CRISPR-Cas復(fù)合物熒光標(biāo)記方案,其利用分選酶識別蛋白N端或C端的短肽標(biāo)簽,將小型熒光肽定點偶聯(lián)到CRISPR復(fù)合物上。這種標(biāo)記方式避免了傳統(tǒng)標(biāo)記中苛刻條件或大分子表位對CRISPR復(fù)合物活性的破壞,且分選酶在高離子強度、4℃等溫和條件下仍保持活性,兼容多種有機熒光團。標(biāo)記后的復(fù)合物可用于DNA幕簾技術(shù)中的單分子熒光成像,實現(xiàn)對CRISPR-Cas復(fù)合物與DNA相互作用的動態(tài)追蹤【1】
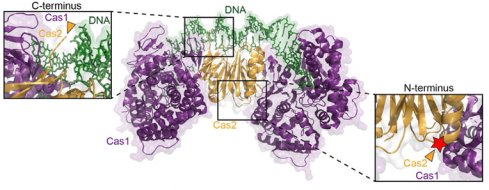
圖:N-terminal sortase labeling of Cas1-Cas2. Structure of Cas1-Cas2 complexed with DNA
②生物素標(biāo)記與高靈敏度檢測:有研究首次證實分選酶A的非典型異肽連接活性可用于重組蛋白修飾。實驗中,研究者用生物素修飾的LPETG肽作為底物,在分選酶A催化下,將生物素特異性偶聯(lián)到Fn3-PLN3-ELP融合蛋白的菌毛結(jié)構(gòu)域賴氨酸上,之后通過鏈霉親和素-Cy5進行免疫印跡檢測,結(jié)合SDS-PAGE和基質(zhì)輔助激光解吸電離飛行時間質(zhì)譜驗證,只有含菌毛結(jié)構(gòu)域和生物素修飾LPETG肽的反應(yīng)體系才會出現(xiàn)目標(biāo)蛋白的生物素化條帶。該方式實現(xiàn)了生物素對蛋白特定位點的精準(zhǔn)標(biāo)記,借助鏈霉親和素系統(tǒng)達(dá)成了目標(biāo)蛋白的高靈敏度鑒定?!?】
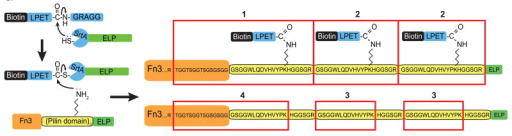
圖:Sortase A catalyzes protein-small molecule isopeptide ligation
③位點特異性交聯(lián):為實時觀察流感病毒出芽過程中糖蛋白的動態(tài),研究者采用分選酶A介導(dǎo)的位點特異性標(biāo)記策略。研究者先對流感病毒的血凝素(HA)和神經(jīng)氨酸酶(NA)這兩種糖蛋白進行基因修飾,使其攜帶LPXTG識別序列。隨后用分選酶A催化含特定功能基團的寡甘氨酸探針與糖蛋白交聯(lián)標(biāo)記。該標(biāo)記方式可在感染狀態(tài)下特異性標(biāo)記病毒糖蛋白,且不影響病毒活性,成功實現(xiàn)對活細(xì)胞內(nèi)流感病毒糖蛋白的定位追蹤,為解析病毒包膜成分組裝及病毒顆粒形成的分子機制提供了關(guān)鍵工具。【3】
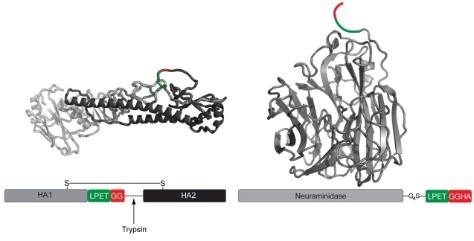
圖: Structural representation of sortase cleavage site mutations in hemagglutinin and neuraminidase
分選酶A正以其“位點精準(zhǔn)、反應(yīng)溫和、普適性強”的獨特優(yōu)勢,正重新塑造蛋白質(zhì)標(biāo)記與功能化的技術(shù)標(biāo)準(zhǔn)。無論是科研還是企業(yè)需求,分選酶A都提供了最優(yōu)選擇,因此正成為推動蛋白質(zhì)科學(xué)與生物產(chǎn)業(yè)創(chuàng)新的核心動力!
產(chǎn)品訂購
產(chǎn)品名稱 | 產(chǎn)品貨號 | 包裝規(guī)格 |
Seebio? 分選酶A(Sortase A) | ECE0720A-50μg | 50μg/100μg/1mg/支 |
相關(guān)產(chǎn)品
產(chǎn)品名稱 | 產(chǎn)品貨號 | 包裝規(guī)格 |
Seebio? 重組煙草蝕紋病毒蛋白酶(TEV酶) | EBY3644B | 5mg/10mg |
Seebio?TEV 蛋白酶(TEV Protease)活性測定試劑盒(熒光法) | EKM0101B | 50T |
SUMO 蛋白酶(凍干粉) | EAE0087A | 1mg |
重組腸激酶 | ECE1123A | 100U |
大腸桿菌表達(dá)重組腸激酶(不帶標(biāo)簽) | DAA1065A | 100U |
重組HRV 3C蛋白酶 | FCE1220A | 1KU |
參考文獻
【1】Dillard KE, Schaub JM, Brown MW, Saifuddin FA, Xiao Y, Hernandez E, Dahlhauser SD, Anslyn EV, Ke A, Finkelstein IJ. Sortase-mediated fluorescent labeling of CRISPR complexes. Methods Enzymol. 2019;616:43-59. doi: 10.1016/bs.mie.2018.10.031.
【2】Bellucci JJ, Bhattacharyya J, Chilkoti A. A noncanonical function of sortase enables site-specific conjugation of small molecules to lysine residues in proteins. Angew Chem Int Ed Engl. 2015 Jan 7;54(2):441-5. doi: 10.1002/anie.201408126.
【3】Popp MW, Karssemeijer RA, Ploegh HL. Chemoenzymatic site-specific labeling of influenza glycoproteins as a tool to observe virus budding in real time. PLoS Pathog. 2012;8(3):e1002604. doi: 10.1371/journal.ppat.1002604.
在蛋白質(zhì)研究與應(yīng)用中,“精準(zhǔn)標(biāo)記”與“定向功能化”是突破技術(shù)瓶頸的關(guān)鍵,不僅要保證蛋白質(zhì)天然活性不受影響,又要實現(xiàn)修飾分子的位點可控、高效偶聯(lián)。對于傳統(tǒng)化學(xué)偶聯(lián)的隨機修飾、產(chǎn)物不均一問題,長期制約著蛋白質(zhì)在科研與產(chǎn)業(yè)中的價值釋放。而分選酶A(SortaseA)介導(dǎo)的生物偶聯(lián)技術(shù),以其“位點精準(zhǔn)、反應(yīng)溫和、普適性強”的獨特優(yōu)勢,業(yè)已成為蛋白質(zhì)標(biāo)記與功能化領(lǐng)域的“明星技術(shù)”,為各類應(yīng)用場景提供了標(biāo)準(zhǔn)化解決方案。
一、蛋白質(zhì)修飾的“精準(zhǔn)導(dǎo)航系統(tǒng)”
分選酶A具有嚴(yán)格的“底物識別-催化偶聯(lián)”機制:
識別精準(zhǔn)性:僅特異性結(jié)合目標(biāo)蛋白上的LPXTG短肽標(biāo)簽,修飾分子需攜帶互補的甘氨酸序列,形成“鎖鑰式”配對。
反應(yīng)溫和性:無需高溫、強酸堿或有毒化學(xué)催化劑,在生理條件下(pH6.5-8.0、室溫)即可高效反應(yīng)。
偶聯(lián)穩(wěn)定性:催化形成的肽鍵在體內(nèi)外均具備高度穩(wěn)定性,不易水解或脫靶,解決了傳統(tǒng)化學(xué)偶聯(lián)(如馬來酰亞胺-巰基反應(yīng))中修飾分子易脫落的問題。
二、蛋白質(zhì)標(biāo)記與功能化的關(guān)鍵應(yīng)用場景
①熒光標(biāo)記與動態(tài)追蹤:Dillard KE等人研究提出了一種分選酶介導(dǎo)的CRISPR-Cas復(fù)合物熒光標(biāo)記方案,其利用分選酶識別蛋白N端或C端的短肽標(biāo)簽,將小型熒光肽定點偶聯(lián)到CRISPR復(fù)合物上。這種標(biāo)記方式避免了傳統(tǒng)標(biāo)記中苛刻條件或大分子表位對CRISPR復(fù)合物活性的破壞,且分選酶在高離子強度、4℃等溫和條件下仍保持活性,兼容多種有機熒光團。標(biāo)記后的復(fù)合物可用于DNA幕簾技術(shù)中的單分子熒光成像,實現(xiàn)對CRISPR-Cas復(fù)合物與DNA相互作用的動態(tài)追蹤【1】

圖:N-terminal sortase labeling of Cas1-Cas2. Structure of Cas1-Cas2 complexed with DNA
②生物素標(biāo)記與高靈敏度檢測:有研究首次證實分選酶A的非典型異肽連接活性可用于重組蛋白修飾。實驗中,研究者用生物素修飾的LPETG肽作為底物,在分選酶A催化下,將生物素特異性偶聯(lián)到Fn3-PLN3-ELP融合蛋白的菌毛結(jié)構(gòu)域賴氨酸上,之后通過鏈霉親和素-Cy5進行免疫印跡檢測,結(jié)合SDS-PAGE和基質(zhì)輔助激光解吸電離飛行時間質(zhì)譜驗證,只有含菌毛結(jié)構(gòu)域和生物素修飾LPETG肽的反應(yīng)體系才會出現(xiàn)目標(biāo)蛋白的生物素化條帶。該方式實現(xiàn)了生物素對蛋白特定位點的精準(zhǔn)標(biāo)記,借助鏈霉親和素系統(tǒng)達(dá)成了目標(biāo)蛋白的高靈敏度鑒定?!?】

圖:Sortase A catalyzes protein-small molecule isopeptide ligation
③位點特異性交聯(lián):為實時觀察流感病毒出芽過程中糖蛋白的動態(tài),研究者采用分選酶A介導(dǎo)的位點特異性標(biāo)記策略。研究者先對流感病毒的血凝素(HA)和神經(jīng)氨酸酶(NA)這兩種糖蛋白進行基因修飾,使其攜帶LPXTG識別序列。隨后用分選酶A催化含特定功能基團的寡甘氨酸探針與糖蛋白交聯(lián)標(biāo)記。該標(biāo)記方式可在感染狀態(tài)下特異性標(biāo)記病毒糖蛋白,且不影響病毒活性,成功實現(xiàn)對活細(xì)胞內(nèi)流感病毒糖蛋白的定位追蹤,為解析病毒包膜成分組裝及病毒顆粒形成的分子機制提供了關(guān)鍵工具?!?】

圖: Structural representation of sortase cleavage site mutations in hemagglutinin and neuraminidase
分選酶A正以其“位點精準(zhǔn)、反應(yīng)溫和、普適性強”的獨特優(yōu)勢,正重新塑造蛋白質(zhì)標(biāo)記與功能化的技術(shù)標(biāo)準(zhǔn)。無論是科研還是企業(yè)需求,分選酶A都提供了最優(yōu)選擇,因此正成為推動蛋白質(zhì)科學(xué)與生物產(chǎn)業(yè)創(chuàng)新的核心動力!
產(chǎn)品訂購
產(chǎn)品名稱 | 產(chǎn)品貨號 | 包裝規(guī)格 |
Seebio? 分選酶A(Sortase A) | ECE0720A-50μg | 50μg/100μg/1mg/支 |
相關(guān)產(chǎn)品
產(chǎn)品名稱 | 產(chǎn)品貨號 | 包裝規(guī)格 |
Seebio? 重組煙草蝕紋病毒蛋白酶(TEV酶) | EBY3644B | 5mg/10mg |
Seebio? TEV 蛋白酶(TEV Protease)活性測定試劑盒(熒光法) | EKM0101B | 50T |
SUMO 蛋白酶(凍干粉) | EAE0087A | 1mg |
重組腸激酶 | ECE1123A | 100U |
大腸桿菌表達(dá)重組腸激酶(不帶標(biāo)簽) | DAA1065A | 100U |
重組HRV 3C蛋白酶 | FCE1220A | 1KU |
參考文獻
【1】Dillard KE, Schaub JM, Brown MW, Saifuddin FA, Xiao Y, Hernandez E, Dahlhauser SD, Anslyn EV, Ke A, Finkelstein IJ. Sortase-mediated fluorescent labeling of CRISPR complexes. Methods Enzymol. 2019;616:43-59. doi: 10.1016/bs.mie.2018.10.031.
【2】Bellucci JJ, Bhattacharyya J, Chilkoti A. A noncanonical function of sortase enables site-specific conjugation of small molecules to lysine residues in proteins. Angew Chem Int Ed Engl. 2015 Jan 7;54(2):441-5. doi: 10.1002/anie.201408126.
【3】Popp MW, Karssemeijer RA, Ploegh HL. Chemoenzymatic site-specific labeling of influenza glycoproteins as a tool to observe virus budding in real time. PLoS Pathog. 2012;8(3):e1002604. doi: 10.1371/journal.ppat.1002604.



